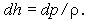
В предыдущем разделе приведен метод расчета температуры адиабатического горения и состава продуктов в камере сгорания. Рассмотрим теперь более детально процесс расширения продуктов сгорания в сопле. Для того чтобы выявить важные особенности протекания химических реакций, пренебрежем диссипативными потерями, связанными с трением и теплопередачей, и будем считать, что на входе в сопло газы имеют нулевую скорость, а их температура и состав найдены по описанной выше процедуре.
Известно, что энтальпия торможения продуктов сгорания высока и распределена по различным степеням свободы молекул в виде поступательного, вращательного и колебательного движений, а также энергии диссоциации молекул (энергию электронного возбуждения и ионизации можно не рассматривать, так как температуры в камере сгорания не настолько высоки).
Поскольку при расширении газов в сопле значительная часть энтальпии преобразуется в кинетическую энергию, возникает вопрос, какие из степеней свободы могут запаздывать в процессе такого преобразования. Равновесие по поступательным и вращательным степеням свободы достигается очень быстро, тогда как релаксация колебательной энергии к новому равновесному состоянию для молекул O2 и Н2 при температуре Tк происходит за времена порядка 10-8 с. Время релаксации колебательной энергии уменьшается с повышением температуры пропорционально exp(T-1/3). Что же касается процесса релаксации к равновесию по диссоциации, то он может оказаться существенным при временах расширения порядка 10-4 с и меньше, что характерно для малоразмерных двигателей (с тягой ~250 Н и длиной сопла менее 5 см). Для двигателей тягой ~ 500 H и выше эти эффекты, как правило, несущественны, хотя для двигателей на высокоэнергетических топливах и камер с низкими значениями pк их все же надо рассматривать.
Если характерные времена реакции много меньше характерного времени расширения газа в сопле, то устанавливается химическое равновесие и о таком течении говорят как о равновесном. Если же расширение происходит настолько быстро, что химические реакции в сопле не успевают произойти, то говорят о замороженном течении. Эти два случая являются предельными и соответствуют бесконечной и нулевой скоростям реакции. В общем случае химические реакции развиваются с некоторой конечной скоростью. В прошлом при расчете характеристик ракетных двигателей течение полагали либо равновесным, либо замороженным [59]; к настоящему же времени появилась возможность расчета рабочего процесса с учетом точных конечных скоростей химических реакций для все более расширяющегося класса ракетных топлив. Существует, однако, и несколько полезных приближенных подходов, в которых используется метод Брэя [16, 17] для сверхзвукового сопла. Отметим, что два указанных выше предельных процесса являются изоэнтропическими, тогда как при конечной скорости реакции энтропия возрастает.
Изоэнтропичность равновесного и замороженного течений можно проверить следующим образом. Из закона сохранения энергии следует:
| dh + 1/2 du2 = 0, | (1.26) |
а если пренебречь диссипативными потерями, то
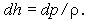 | (1.27) |
Обобщенное уравнение с учетом химических реакций имеет вид
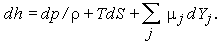 | (1.28) |
Здесь 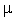 j - химический потенциал компоненты j, а Yj, - ее массовая концентрация. Из уравнений (1.27) и (1.28) следует
j - химический потенциал компоненты j, а Yj, - ее массовая концентрация. Из уравнений (1.27) и (1.28) следует
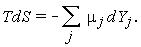 | (1.29) |
В случае когда химический состав заморожен, т.е. dYj=0, имеем dS=0. Это означает, что замороженное течение является изоэнтропическим.
Для одноступенчатой обратимой химической реакции скорость образования компоненты j можно записать в следующем виде:
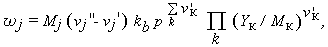 | (1.30) |
где vj - стехиометрические коэффициенты. Если за время dt степень развития некоторой реакции R незначительна, то
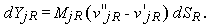 | (1.31) |
Здесь величина SR содержит все входящие в уравнение реакции члены, которые могут изменяться по мере расширения газа в сопле. Полное изменение величины Yj можно записать следующим образом:
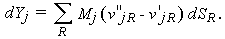 | (1.32) |
Подставляя это соотношение в (1.29), получим
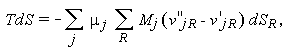 |
или, после изменения порядка суммирования,
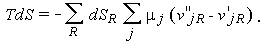 | (1.33) |
Но член с суммированием по j есть не что иное, как изменение свободной энергии за время dt. Записав
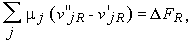 |
окончательно получим
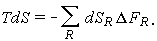 | (1.34) |
Если dSR = 0, т.е. константа скорости реакции стремится к нулю, мы вновь приходим к уравнению (1.29). При равновесном течении 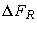 = 0, поскольку это и есть условие химического равновесия.
= 0, поскольку это и есть условие химического равновесия.
На рис. 2 приведена трехмерная диаграмма состояния химически реагирующей системы в координатах энтальпия - энтропия - состав. Для простоты здесь рассмотрена координата лишь одной реакции. На диаграмме показаны две плоскости постоянной энтропии: в плоскости A течение происходит при условии химического равновесия и направлено из точки С в точку I; в плоскости В, соответствующей большему значению энтропии, реализуется течение без изменения состава из точки G в точку А. Между точками I и G реакция протекает с конечной скоростью, и состояния системы между этими точками по существу неопределенны. Чтобы определить их, следует выполнить полный расчет с учетом конечной скорости химического превращения. Такой метод довольно сложен, требует много времени и здесь не рассматривается. Ввиду того что существует значительная неопределенность в константах скоростей химических реакций, оправданно применение упрощенной процедуры расчета.
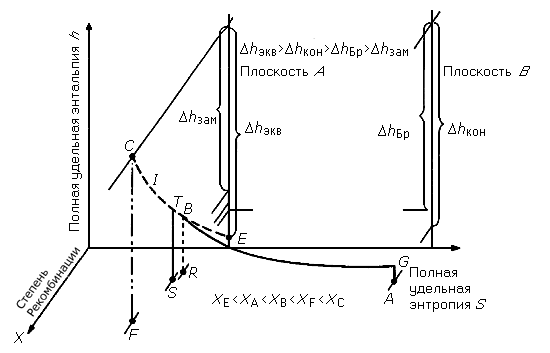
Замечено, что переходная область от равновесного к замороженному течению очень узка, и, согласно Брэю, при рассмотрении течения с множеством химических реакций можно выбрать одну определяющую реакцию, которая и станет предметом исследования. Хотя существует целый ряд элементарных стадий химического превращения, все же к наиболее медленным стадиям следует отнести процессы рекомбинации атомов при тройном соударении. Разумеется, в каждом конкретном случае следует выбирать соответствующую определяющую реакцию. Например, для системы Н2 - O2 такой реакцией является
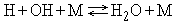 .
.
Чтобы определить состояние системы, в котором выбранная реакция "замораживается", Брэй оценивает порядок различных членов уравнения реакции:
| u (dYi / dz) = rf - rb , | (1.35) |
где rf и rb-скорости прямой и обратной реакций соответственно. Проанализируем три возможных случая.
1. Если течение близко к равновесному, как и в начале расширения, то
| rf ~ rb. | (1.36) |
Тогда
2. В переходной области все параметры: rf , rb и
3. Если течение близко к замороженному, то либо rf << rb , либо rb << rf , и величина
| (1.37) |
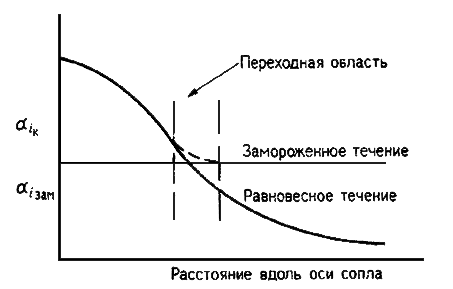
На рис. 3 эта ситуация показана графически. Поскольку переходная область очень мала, то условие замораживания примет вид
| (1.38) |
Положив, что в точке, определяемой одним из этих уравнений, происходит замораживание реакции, можно оценить входящие в них величины, рассмотрев течение, близкое к равновесному:
| (1.39) |
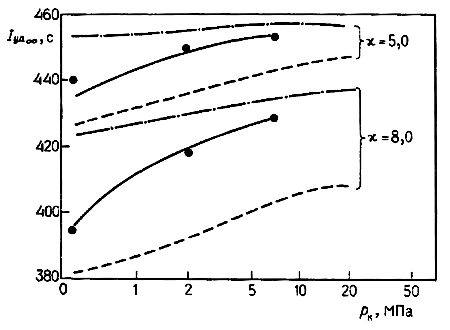
Чтобы выполнить расчет, следует сначала определить по всей длине сопла состав, давление, температуру, скорость и т.д. для равновесного течения, а затем рассчитать соответствующие значения rf и сравнить их со значениями величины 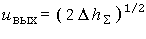 .
.
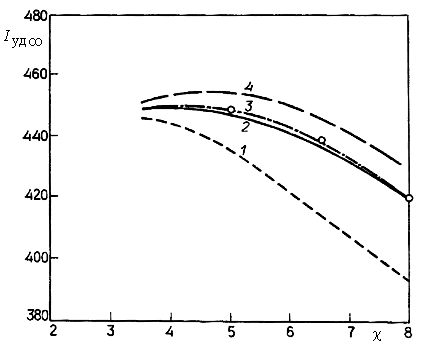 |
Рис. 4. Влияние соотношения компонентов топлива
1 - замороженное течение; |
На рис. 4 приведены результаты расчетов удельного импульса для топлива Н2 - O2 при pк = 2,07 МПа и степени расширения сопла, равной 40, в виде зависимости от отношения массы окислителя к массе горючего.
 | равновесное течение; |
 | модифицированное решение Брэя; |
 | замороженное течение; |
На рис. 5 показано изменение величины 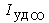 в зависимости от давления в камере (до 6,89 МПа) для двух значений отношения
в зависимости от давления в камере (до 6,89 МПа) для двух значений отношения 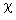 . Видно, что при увеличении давления результаты кинетических расчетов приближаются к равновесному решению, а при очень низких рк они близки к "замороженному" решению. Эта особенность является одной из причин того, что для достижения высоких Iуд на новых ЖРД типа маршевого двигателя ВКС "Спейс Шаттл" используются очень высокие давления в камере сгорания.
. Видно, что при увеличении давления результаты кинетических расчетов приближаются к равновесному решению, а при очень низких рк они близки к "замороженному" решению. Эта особенность является одной из причин того, что для достижения высоких Iуд на новых ЖРД типа маршевого двигателя ВКС "Спейс Шаттл" используются очень высокие давления в камере сгорания.

Процедура расчета характеристик камеры показана на рис. 2. Модифицированный процесс Брэя изображается следующим образом: течение начинается из точки С, соответствующей условиям в камере сгорания, и происходит вдоль равновесной кривой до точки замораживания В, расположенной сразу за горловиной сопла. Поскольку между точками С и В течение предполагается равновесным, процесс на этом участке считается изоэнтропическим. Далее процесс развивается из точки В в точку R, оставаясь замороженным.
Легко получить оценку, допустив, что до критического сечения течение равновесное, а после него - замороженное. Такой процесс также происходит в плоскости A и изображен линией C-T-S на рис. 2. На рис. 2 показаны также соответствующие изменения энтропии: полностью равновесное течение представлено линией С-Е, полностью замороженное - C-F, течение с конечными скоростями реакций - C-I-G-A, модифицированное приближенное решение Брэя - C-B-R и приближенное решение Брэя - C-T-S.
Наконец, интересно отметить, что в недавней работе Глика и Акри [55] показана приемлемость одномерного расчета для РДТТ. Как станет ясно из дальнейшего изложения, для ЖРД этот вывод несправедлив.